Säure-Base-Titrationen
Wie hilft die Neutralisation dabei, die Stärke einer Säure oder Base mithilfe einer Titration zu bestimmen?
Jetzt mit Spass die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Säure-Base-Titration
Das Ziel einer Säure-Base-Titration ist es, die Konzentration einer Säure oder Base zu bestimmen. Dazu macht man sich die Neutralisationsreaktion zu Nutze. Dabei reagiert eine Säure mit einer Base zu einem Salz und Wasser. Im Detail bedeutet das, ein Oxonium-Ion $H_3O^+$ reagiert mit einem Hydroxid-Ion $OH^-$ und es bildet sich Wasser.
$H_3O^+ + OH^- \longrightarrow~2~H_2O$
Es wird immer eine Lösung unbekannter Konzentration, die Analysenlösung, mit einer Lösung bekannter Konzentration, der Maßlösung, titriert. Durch den Verbrauch an Maßlösung ist es möglich, unter Berücksichtigung der Reaktion und dessen Stöchiometrie, die Konzentration der Analysenlösung zu berechnen. Endpunkt einer Titration ist der Äquivalenzpunkt. An diesem Punkt sind die Stoffmengen von Oxoniumionen und Hydroxidionen gleich. Es liegt also ein vollständiger Umsatz der Säure vor und die Konzentration kann berechnet werden. Zum Aufbau einer Titration gehört in jedem Fall eine Bürette.
Sie beinhaltet die Maßlösung. Die Bürette dient dazu, die Maßlösung tropfenweise zur Analysenlösung zu geben und das zugetropfte Volumen genau ablesen zu können. Außerdem wird noch ein Gefäß für die Analysenlösung und unter Umständen ein Magnetrührer benötigt. Unverzichtbar ist in jedem Fall der Indikator. Dieser zeigt den Äquivalenzpunkt und damit das Ende der Titration durch einen Farbumschlag an. Wichtige Indikatoren sind Phenolphthalein, Methylorange, Lackmus und Rotkohlsaft.
Titration starker Säure mit starker Base
Wie läuft so eine Titration nun konkret ab? Schauen wir uns die Titration von Salzsäure mit Natronlauge an. Die starke Säure Salzsäure ist die Analysenlösung. Mit der starken Base Natronlauge wird titriert. Sie ist die Maßlösung mit einer Konzentration von $0,1~\frac{mol}{l}$. Das Volumen der Salzsäure beträgt $10~ml$. Da die Konzentration hier in $\frac{mol}{l}$ angegeben ist, musst du die $ml$ in $l$ umrechnen. $10~ml$ sind umgerechnet $0,01~l$.
Nachdem der Aufbau mit Bürette, Titriergefäß und Indikator steht, kann mit der Titration begonnen werden. Die Natronlauge wird langsam und tropfenweise hinzugegeben. Der Äquivalenzpunkt ist erreicht, wenn der Indikator einen Farbumschlag zeigt. An der Bürette liest du einen Verbrauch von $5~ml$, also $0,005~l$, ab.
Aus der Reaktionsgleichung kannst du erkennen, dass $1~mol$ Natronlauge zur Neutralisation von $1~mol$ Salzsäure benötigt wird.
$HCl + NaOH \longrightarrow~H_2O + NaCl$
Das Verhältnis von Säure und Base ist daher 1:1. Am Äquivalenzpunkt gilt $n(HCl)=n(NaOH)$. Du benötigst also die Stoffmenge der Natronlauge, um dann letztendlich die Konzentration der Salzsäure zu berechnen. Dafür brauchst du nur die Formel $c = \frac{n}{V}$. Die Konzentration ist also der Quotient aus Stoffmenge und Volumen, wie du auch an ihrer Einheit $\frac{mol}{l}$ sehen kannst.
Die Stoffmenge der Natronlauge ist
$n (NaOH)=c(NaOH) \cdot~V(NaOH)= 0,1~\frac{mol}{l} \cdot~0,005~l$
$n(NaOH)= 0,0005~mol$.
Da $n(HCl)=n(NaOH)$, wird diese nun für $n(HCl)$ eingesetzt.
$c(HCl)= n(NaOH) / V(HCl)= 0,0005~l / 0,01~l$
$c(HCl)= 0,05~\frac{mol}{l}$
Die gesuchte Konzentration der Salzsäure beträgt also $0,05~\frac{mol}{l}$.
Bei der Titration einer starken Säure mit einer starken Base ist der Äquivalenzpunkt auch gleichzeitig der Neutralpunkt. Das ist bei anderen Titrationen nicht zwingend der Fall. Dies ist in der Titrationskurve gut zu sehen.
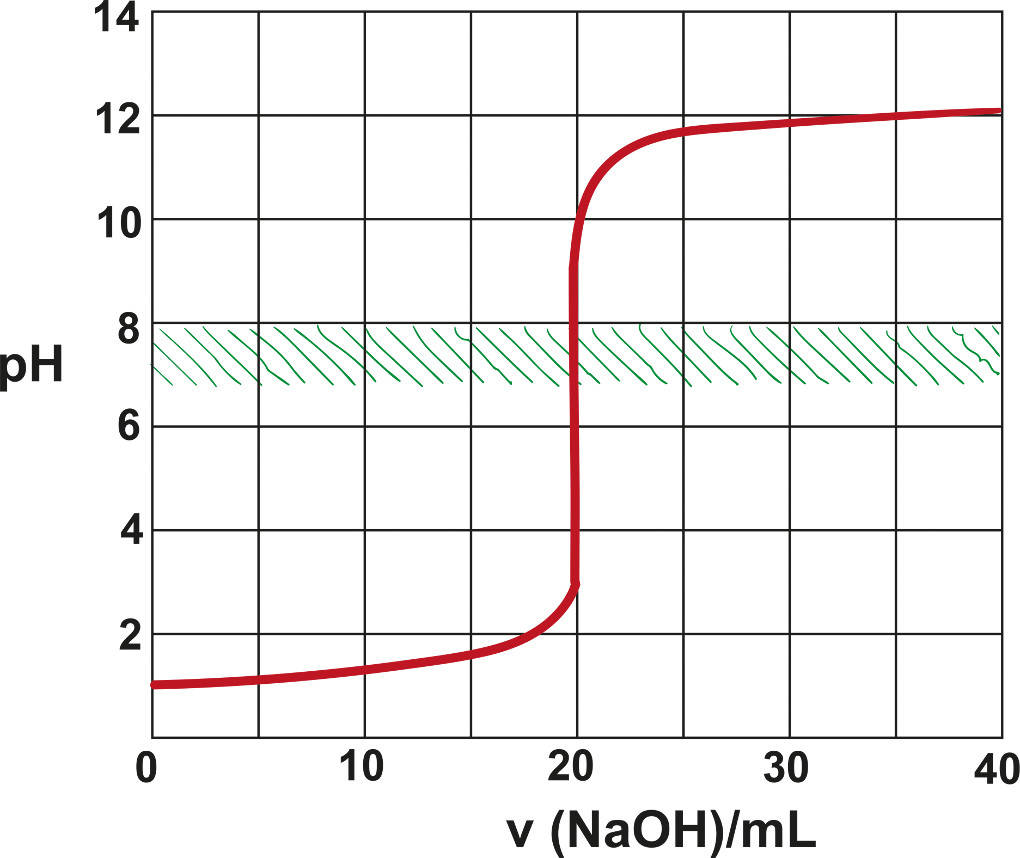
Hier wird das zugegebene Volumen Maßlösung auf der x-Achse und der pH-Wert auf der y-Achse abgetragen. Es zeigt sich zu Beginn nur eine kleine Zunahme des pH-Werts, da noch sehr viele Oxonium-Ionen der Säure vorhanden sind. Dann erfolgt ein sehr sprunghafter Anstieg mit dem Äquivalenzpunkt in der Mitte des Anstiegs bei pH-Wert 7. Danach pegelt sich die Kurve bei einem sehr hohen pH-Wert ein, da hier die Hydroxid-Ionen der Base dominieren.
Titration einer mehrprotonigen Säure
Mehrprotonige Säuren besitzen, im Gegensatz zu einprotonigen Säuren, mehrere Protonen, die abgegeben werden können. Beispiele dafür sind Schwefelsäure $H_2SO_4$, Phosphorsäure $H_3PO_4$ und Kohlensäure $H_2CO_3$. Der Unterschied in der Protonenanzahl zeigt sich bei der Titration solcher Säuren in der Titrationskurve. Es kommen mehrere Äquivalenzpunkte zustande. Diese kann man am sprunghaften Anstieg des pH-Werts erkennen.
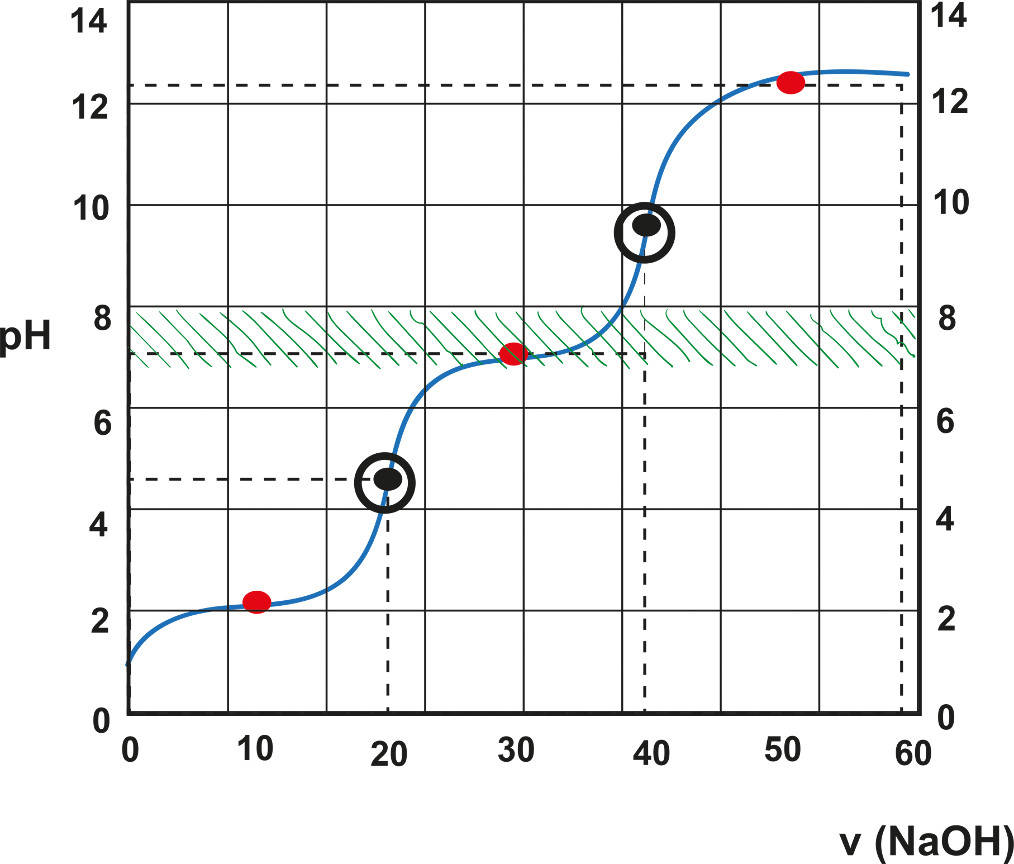
Die Berechnung der Konzentration der Säure verläuft analog zu allen anderen Titrationen. Du benötigst also unbedingt die Formel:
$c = \frac{n}{V}$.
Um das Verhältnis der Säure zur Base richtig zu berücksichtigen, ist auch die richtige Reaktionsgleichung für die Neutralisationsreaktion enorm wichtig.
Alle Videos zum Thema
Videos zum Thema
Säure-Base-Titrationen (8 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Säure-Base-Titrationen (8 Arbeitsblätter)
-
 Rechnen mit Logarithmen
PDF anzeigen
Rechnen mit Logarithmen
PDF anzeigen -
 Säure-Base-Titration (Grundlagen)
PDF anzeigen
Säure-Base-Titration (Grundlagen)
PDF anzeigen -
 Säure-Base-Titration
PDF anzeigen
Säure-Base-Titration
PDF anzeigen -
 Titration – starke Säure mit starker Base
PDF anzeigen
Titration – starke Säure mit starker Base
PDF anzeigen -
 Titration einer schwachen Säure
PDF anzeigen
Titration einer schwachen Säure
PDF anzeigen -
 Titration einer mehrprotonigen Säure
PDF anzeigen
Titration einer mehrprotonigen Säure
PDF anzeigen -
 Titrationskurve und Puffereigenschaften von Aminosäuren
PDF anzeigen
Titrationskurve und Puffereigenschaften von Aminosäuren
PDF anzeigen -
 Volumetrie
PDF anzeigen
Volumetrie
PDF anzeigen
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Ethansäure
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- fraktionierte Destillation
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung


















