Grundlagen der Reaktionsgeschwindigkeit
Die Reaktionsgeschwindigkeit gibt an, wie schnell eine Reaktion abläuft. Durch Veränderung der Reaktionsbedingungen kann man auch die Reaktionsgeschwindigkeit beeinflussen.
Jetzt mit Spass die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
- Kollisionstheorie
- Reaktionsgeschwindigkeit und Reaktionsbedingungen
- Reaktionsgeschwindigkeit
- Reaktionsbedingungen
Kollisionstheorie
Die Kollisionstheorie ist eine Theorie zur Erklärung des Eintretens einer Reaktion. Sie besagt, dass es zwischen den Reaktionspartnern zu effektiven Stößen kommen muss, damit eine Reaktion stattfindet. Am besten kann diese Theorie Vorhersagen treffen bei Reaktionen in der Gasphase mit kugelförmigen Ionen. Damit es zu einem effektiven Zusammenstoß kommt, muss eine bestimmte Schwellenenergie bei der Kollision überschritten werden. Diese Energie ist die Aktivierungsenergie. Die Teilchen benötigen also eine gewisse Geschwindigkeit mit der sie dann aufeinander treffen. Die Aktivierungsenergie ist also das Mindestmaß an kinetischer Energie, die die Reaktionspartner benötigen, damit eine Reaktion stattfindet.
Ist die Temperatur von der Reaktionsgeschwindigkeit abhängig? Die Geschwindigkeit der Teilchen kann mithilfe der Temperatur beeinflusst werden. Die Temperatur stellt also ein Maß für die kinetische Energie der Teilchen eines Stoffes dar. Je höher die Temperatur, desto höher die Energie der Teilchen und somit auch ihrer Geschwindigkeit. Bei höherer Geschwindigkeit kommt es zu mehr effektiven Zusammenstößen. Dadurch steigt mit zunehmender Temperatur auch die Reaktionsgeschwindigkeit.
Reaktionsgeschwindigkeit und Reaktionsbedingungen
Reaktionen verlaufen unterschiedlich schnell. So ist zum Beispiel das Rosten von Eisen eine sehr langsame Reaktion. Die Verbrennung von Magnesium wiederum verläuft sehr schnell. Die Reaktionen unterscheiden sich also hinsichtlich ihrer Reaktionsgeschwindigkeit.
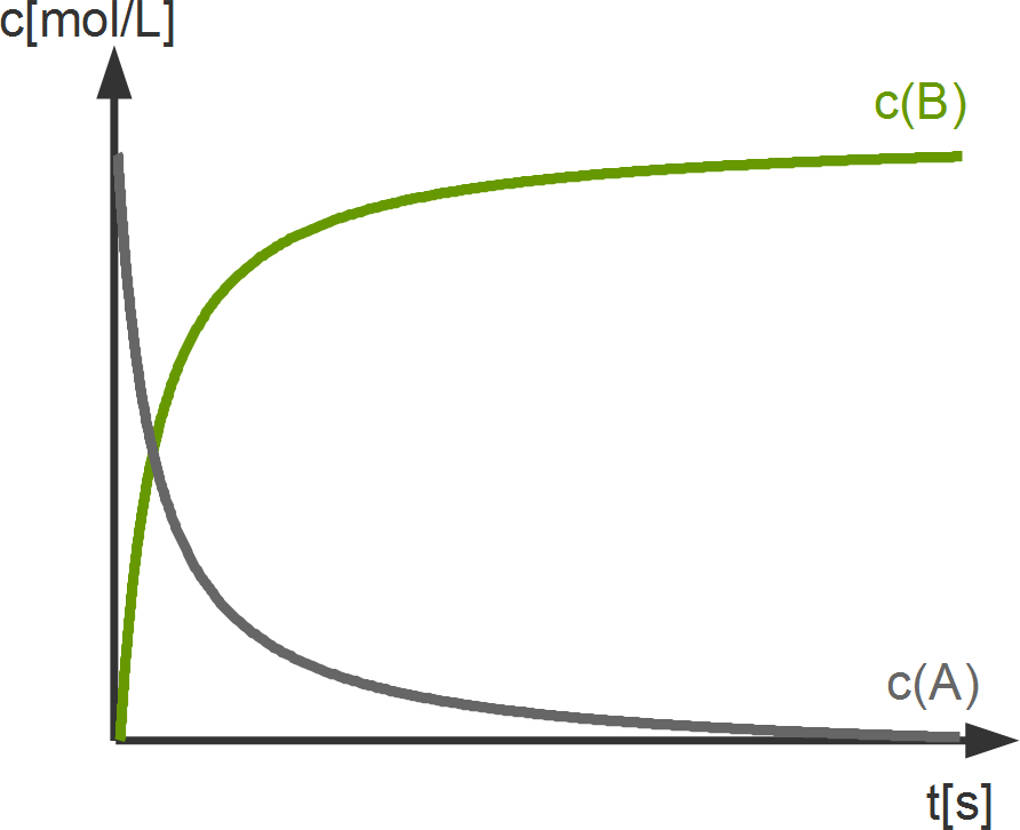
Im Laufe einer Reaktion ändern sich die Konzentrationen der Reaktionspartner. Die Konzentration der Edukte fällt bis zu einem gewissen Punkt ab und die der Produkte steigt bis zu einer gewissen Konzentration. Ändern sich die Konzentrationen nicht mehr ist die Reaktion zu Ende oder es hat sich ein Gleichgewicht in der Reaktion eingestellt.
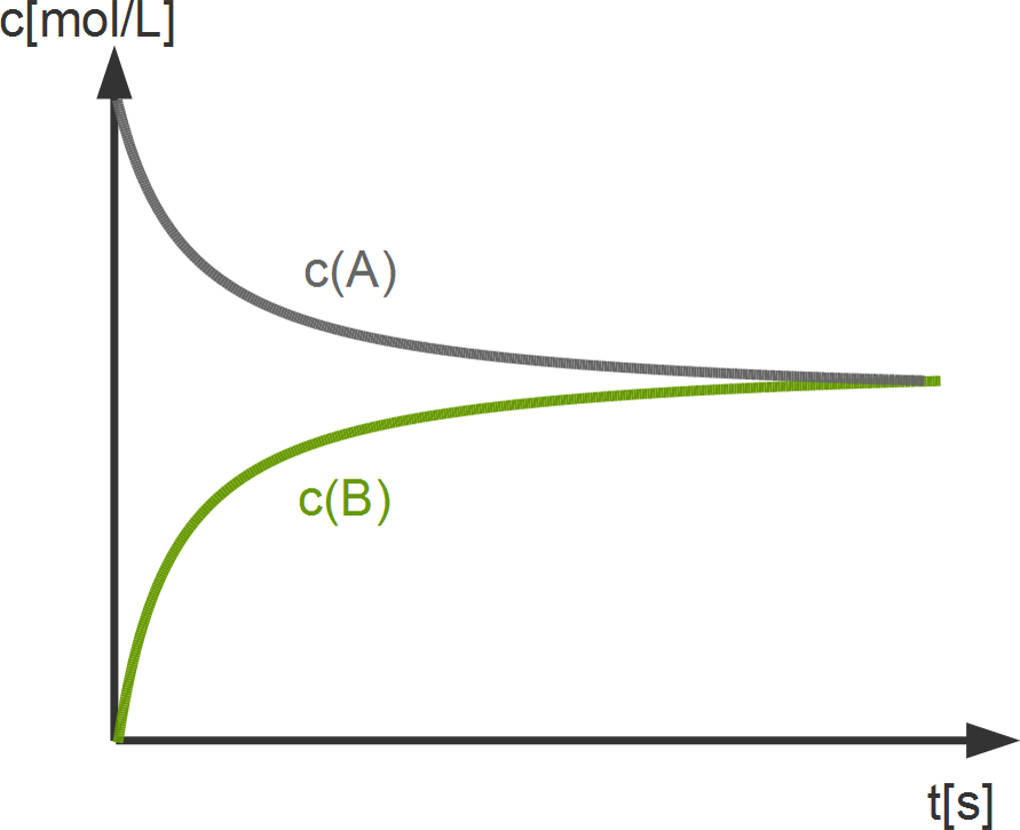
Reaktionsgeschwindigkeit
Betrachten wir die Reaktion von $A \rightleftharpoons B$ lässt sich die Reaktionsgeschwindigkeit der Hinreaktion auf unterschiedlichen Wegen bestimmen:
- die Abnahme der Konzentration der Edukte über das entsprechende Zeitintervall.
- die Zunahme der Konzentration der Produkte über das entsprechende Zeitintervall.
Daraus folgt für die Hinreaktion:
$v_{Hin}=- \frac{\Delta c(A)}{\Delta t}=\frac{\Delta c(B)}{\Delta t}$.
Durch das negative Vorzeichen erhält man eine positive Geschwindigkeit, da die Konzentrationsänderung der Edukte negativ ist (Konzentrationsabnahme). Ob man die Abnahme der Edukte oder die Zunahme der Produkte nutzt, entscheidet sich bei der Messung.
Stellt sich nach einer Weile ein Gleichgewicht ein, ist die Geschwindigkeit der Hinreaktion genau so groß wie die Geschwindigkeit der Rückreaktion, daher ändert sich die Konzentration der Produkte und Edukte nach außen hin nicht mehr.
Da man bei einer chemischen Reaktion aber möglichst hohe Ausbeuten eines Produktes erzielen möchte, stört man dieses Gleichgewicht ganz bewusst über die Wahl der Reaktionsbedingungen.
Reaktionsbedingungen
Die Bedingungen der Reaktion bestimmen maßgeblich die Reaktionsgeschwindigkeit. Je höher die Konzentration der Edukte, desto höher auch die Reaktionsgeschwindigkeit. Dies lässt sich durch die stetige Zufuhr der Edukte erreichen. Durch das Vorhandensein von vielen Eduktteilchen auf kleinem Raum ist ein effektiver Zusammenstoß deutlich wahrscheinlicher und läuft öfter ab. Auch die Temperatur beeinflusst die Geschwindigkeit. Je höher die Temperatur desto höher ist die Geschwindigkeit der Teilchen und somit kommt es zu mehr effektiven Kollisionen. Die RGT-Regel (Reaktionsgeschwindigkeits-Temperatur-Regel) besagt, dass sich die Reaktionsgeschwindigkeit bei einer Erhöhung der Temperatur von 10 K verdoppelt bis vervierfacht.
Reaktionsordnung
Eine chemische Reaktion lässt sich in einer Reaktionsgleichung aufstellen und beschreiben. Anhand dieser kann man ablesen, wie viele Teilchen miteinander reagieren, um das oder die Produkte zu bilden. Komplexere Reaktionen werden in sogenannte Elementarreaktionen zerlegt. Dies sind kleine Schritte der Reaktion auf denen Zwischenprodukte entstehen. Je nach dem wie viele Teilchen miteinander kollidieren müssen, wird die Reaktion dann in eine Reaktionsordnung eingeordnet.
Die Reaktiongeschwindigkeit der Reaktion von A zu B $(A\longrightarrow)$ z.B. hängt nur von der Konzentration von A ab, da kein anderes Teilchen benötigt wird. Dies ist eine Reaktion 1. Ordnung. Das Geschwindigkeitsgesetz dazu lautet:
$v=k\cdot c(A)$.
$k$ ist dabei die Geschwindigkeitskonstante.
Die Reaktiongeschwindigkeit von $A + B\longrightarrow~C$ ist von den Konzentrationen von A und B abhängig. Daher ist es eine Reaktion zweiter Ordnung. Das Geschwindigkeitsgesetz lautet folglich:
$v=k\cdot c(A)\cdot c(B)$.
Bei zum Beispiel Oberflächenkatalyse und Enzymreaktion, kann die Reaktion auch unabhängig von jeglicher Konzentration der Edukte sein. Dann liegt eine Reaktion nullter Ordnung vor. Da man hier die Konzentration der Edukte als unendlich betrachtet.
Bei mehrschrittigen Reaktionen, deren Einzelschritte unterschiedliche Reaktionsordnungen haben, wie 1. Ordnung und 2. Ordnung, besitzt die Gesamtreaktion eine Zwischenordnung. In unserem Beispiel ist die Reaktion 1,5. Ordnung.
Wichtig ist hier, dass der langsamste Schritt die Reaktionsgeschwindigkeit bestimmt.
Alle Videos und Lerntexte zum Thema
Videos und Lerntexte zum Thema
Grundlagen der Reaktionsgeschwindigkeit (5 Videos, 1 Lerntext)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Grundlagen der Reaktionsgeschwindigkeit (5 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Ethansäure
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- fraktionierte Destillation
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung







 Kinetik
Kinetik
 Reaktionsgeschwindigkeit und Reaktionsbedingungen
Reaktionsgeschwindigkeit und Reaktionsbedingungen
 Metastabile Systeme
Metastabile Systeme
 Reaktionsgeschwindigkeit und Reaktionsordnung
Reaktionsgeschwindigkeit und Reaktionsordnung
 Temperaturabhängigkeit der Reaktionsgeschwindigkeit
Temperaturabhängigkeit der Reaktionsgeschwindigkeit









