Alkine
Was sind Alkine? – Hier lernst du alles über ihre Isomerie, Nomenklatur und Reaktionen.
Beliebteste Videos
Jetzt mit Spass die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Was sind Alkine?
Die Alkine sind ungesättigte Kohlenwasserstoffverbindungen, die eine oder mehrere Dreifachbindungen aufweisen. Sie sind eng verwandt mit den Alkanen und Alkenen.
Die Endung -in symbolisiert das Vorhandensein einer Dreifachbindung. Die allgemeine Summenformel der Alkine lautet $C_nH_{2n-2}$. Der kleinste Vertreter der Alkine ist das Ethin.
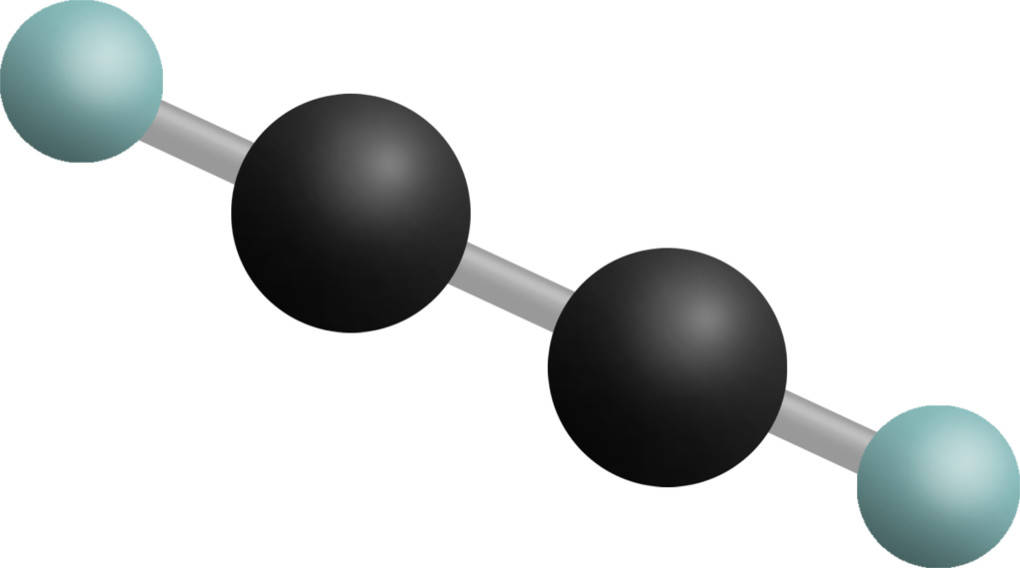
Dieses besteht, wie auf dem Bild gut zu erkennen, aus 2 Kohlenstoffatomen, die über eine Dreifachbindung verknüpft sind, und 2 Wasserstoffatomen. Die charakteristische Dreifachbindung besteht aus einer Sigma-Bindung, die auf der Verbindungsachse zwischen den Kernen verläuft, und zwei Pi-Bindungen, die nicht auf dieser Achse liegen. Die Pi-Bindungen kommen durch die Überlappung der $p_y$-Atomorbitale beider Kohlenstoffe und der Überlappung der $p_z$-Orbitale beider Kohlenstoffe zustande. Diese Pi-Bindungen stehen unter Spannung und sind daher nicht so stark wie die Sigma-Bindung. Da Alkine 2 dieser Bindungen aufweisen, sind sie noch reaktiver als die Alkene. Alkine sind nicht wasserlöslich, aber gut löslich in unpolaren Lösemitteln wie Benzin. Sie weisen eine geringe Siede- und Schmelztemperatur auf. Mit steigender Kettenlänge nehmen diese Temperaturen zu, da die Van-der-Waals-Kräfte zwischen den Molekülen zunehmen.
Isomerie und Nomenklatur
Die Alkine bilden eine homologe Reihe. Das bedeutet, dass die aufeinander folgenden Mitglieder dieser Reihe sich um ein feststehendes Glied unterscheiden. Dabei handelt es sich um eine Methylen-Gruppe $CH_2$, die beim Voranschreiten in der Reihe mit dazukommt. Die Länge der Kette wird mit dem entsprechenden Zahlwort gekennzeichnet. Die ersten dieser Zahlwörter siehst du hier im Bild.
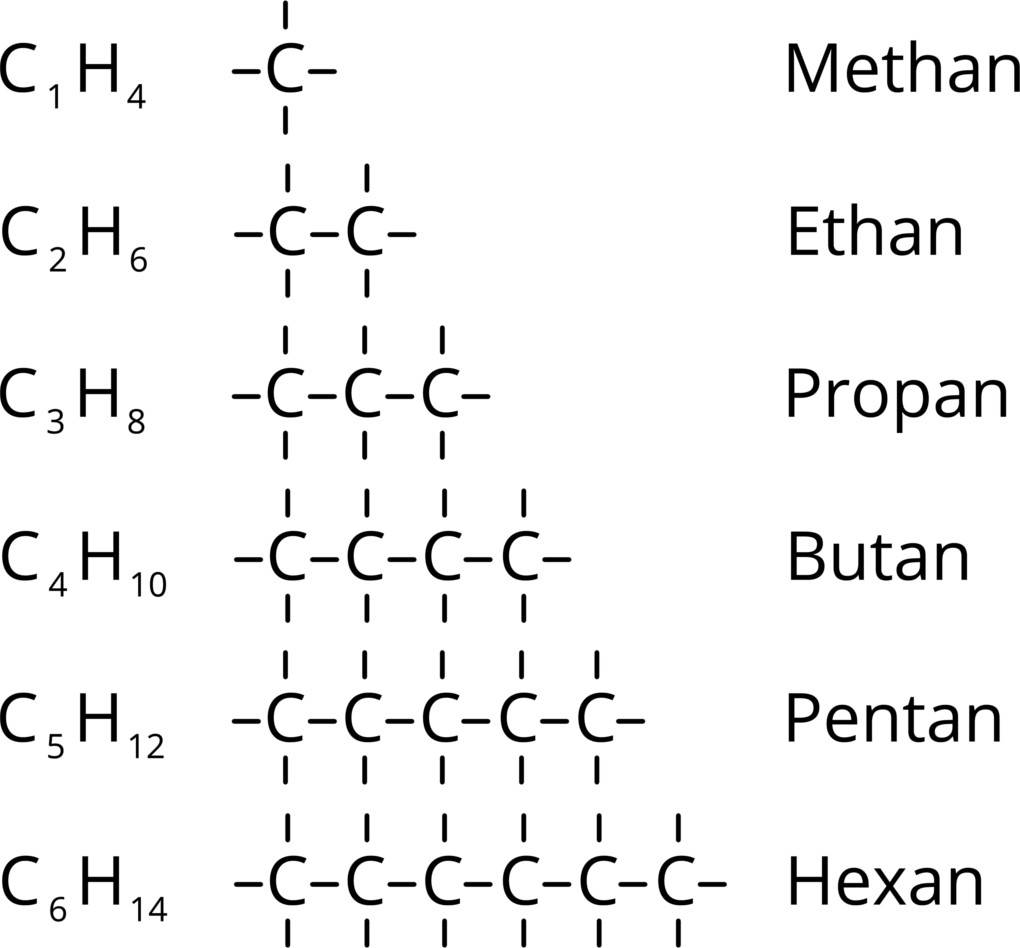
Die längste Kette ist ausschlaggebend für den Hauptnamen der Verbindung. Die Kohlenstoffatome werden durchnummeriert und zwar in die Richtung, so dass die Kohlenstoffatome mit der Dreifachbindung die kleinstmögliche Zahl erhalten. Diese Nummer wird dann vor der Endung -in eingefügt. Wenn Seitenketten vorliegen, werden diese ebenfalls benannt und mit der entsprechenden Nummer betitelt. Ein Beispiel für den Namen eines Alkins wäre dementsprechend 4-Methyl-hex-2-in. Es ist also ein Hexin mit einer Methyl-Gruppe am 4. Kohlenstoffatom und der Dreifachbindung zwischen dem 2. und dem 3. Kohlenstoffatom. Bei den Alkinen treten Isomerien auf. Isomere sind Verbindungen mit gleicher Summenformel aber unterschiedlicher Strukturformel. Diese können durch die unterschiedliche Position der Dreifachbindung zustande kommen. Die Dreifachbindung kann bei einem Hexin z.B. zwischen dem C-Atom 1 und 2 oder zwischen 2 und 3 sitzen. Auch Seitenketten, oft auch Verzweigungen genannt, können zur Isomerie führen. Ein Alkin mit 6 C-Atomen kann z.B. eine Kette aus 6 C-Atomen aufweisen aber auch eine Kette aus 5 C-Atomen und einem Methylrest an den C-Atomen auf Position 2 oder 3. Die Unterschiede zwischen den Molekülen sieht man nur in der Strukturformel, nicht aber wenn man nur die Summenformel betrachtet.
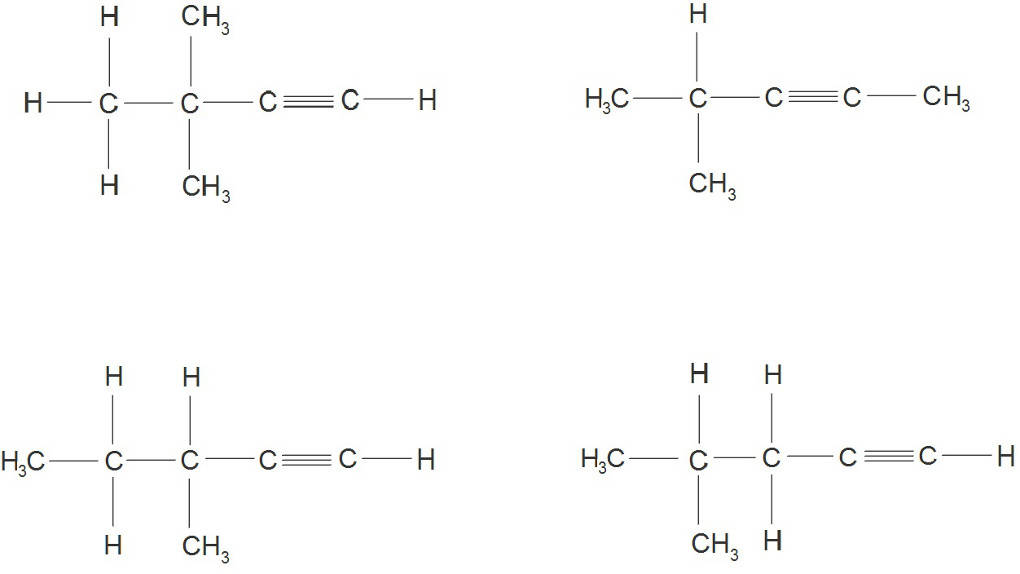
Eine cis/trans Isomerie ist ebenfalls möglich, da die Dreifachbindung im Gegensatz zu einer Einfachbindung nicht frei drehbar ist. Bezogen auf die Kettenreste bedeutet eine cis-Stellung, dass die ersten C-Atome der mit der Dreifachbindung verbundenen Ketten auf derselben Seite stehen. Bei einer trans-Stellung stehen sie auf den gegenüberliegenden Seiten.
Reaktionen
Alkine sind besonders reaktionsfreudig. Die Pi-Bindungen sind schwächer als die vorhandene Sigma-Bindung und bieten daher Angriffspunkte für andere Verbindungen. Die Dreifachbindung stellt einen Ort hoher Elektronendichte dar. Aus diesem Grund sind Alkine äußerst empfänglich für die elektrophile Addition. Dabei greifen Elektrophile, das sind Teilchen, die von negativen Ladungen angezogen werden, die Dreifachbindung an. Diese spaltet sich auf und gibt zwei Bindungen frei, die dann neu besetzt werden. Es entsteht eine Doppelbindung und 2 neue Substituenten befinden sich an den Kohlenstoffatomen der Doppelbindung.
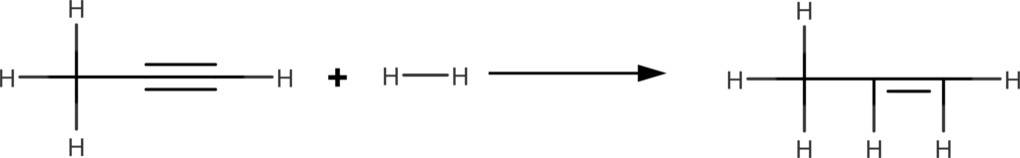
Auf dem Bild siehst du die Addition von Wasserstoff. Dies wird als Hydrierung bezeichnet.
Alkine sind brennbar. Sie reagieren dabei mit ausreichend Sauerstoff zu Wasser und Kohlenstoffdioxid. Alkine zeigen außerdem Reaktionen in denen sie als Säuren fungieren und auch die Reaktion mit Ozon ist möglich.
Alle Videos zum Thema
Videos zum Thema
Alkine (6 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Alkine (6 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation












 Aufbau von Kohlenwasserstoffen
Aufbau von Kohlenwasserstoffen
 Alkine – Einführung
Alkine – Einführung
 Ethin
Ethin
 Alkine – Reaktionen (Vertiefungswissen)
Alkine – Reaktionen (Vertiefungswissen)
 Alkine – Isomerie und Nomenklatur
Alkine – Isomerie und Nomenklatur
 Einfachbindungen, Mehrfachbindungen und Hybridisierung
Einfachbindungen, Mehrfachbindungen und Hybridisierung









